- Производство синтез газа технологическая схема
- Синтез-газ
- Определение
- Получение
- Конверсия метана с паром
- Парциальное окисление метана
- Транспортировка
- Применение
- Получение аммиака
- Получение метанола
- Синтез Фишера-Тропша
- Синтез газ: способы получения, производство, состав и применение
- Состав синтез-газа
- Способы получения синтез-газа
- Производство синтез-газа
- Применение синтез-газа
Производство синтез газа технологическая схема
В промышленном масштабе для производства синтез-газа используют три основных метода.
1. Конверсия природного газа водяным паром и кислородом (процесс фирмы «Taksako»):
2. Окисление тяжелого мазута (процесс фирмы «Shell»):
3. Газификация каменного угля (процесс фирмы «Shell-Koppers»):
При различных методах получения синтез-газа образуется газ с различным соотношением СО / H2:
| Конверсия природного газа водяным паром и кислородом | 1 : 2 |
| Окисление тяжелого мазута | 1 : 1 |
| Газификация угля | 1 : 1 |
Соотношение СО / H2 имеет большое значение для дальнейшей переработки синтез-газа. Например, для синтеза метанола требуется синтез-газ с соотношением СО : H2 = 1 : 2, а для процесса оксосинтеза — 1 : 1.
Получение чистых оксидов углерода и водорода осуществляется методом их выделения из синтез-газа с использованием мембранной технологии. Наиболее технологичным и экономически эффективным процессом получения синтез-газа является конверсия природного газа водяным паром в присутствии кислорода (парокислородная конверсия). Принципиальная технологическая схема производства синтез-газа парокислородной конверсией природного газа приведена на рис. 13.16.
Рис. 13.16. Схема получения синтез-газа:
1 — подогреватель; 2 — адсорбер; 3 — печь; 4 — реактор синтеза;
5 — теплообменник; 6 — скруббер; 7 — мембранная секция;
I — свежий природный газ; II — очищенный газ; III — кислород; IV — продукты синтеза;
V — вода; VI — пар; VII — вода + сажа; VIII — водород; IX — синтез-газ
Природный газ нагревается в подогревателе 1 до 370–400 °С и поступает в адсорбер 2 для стандартной очистки от сернистых соединений. В качестве катализатора используется оксид цинка, нанесенный на глинозем, кольца Рамича и другие носители. Очищенный от серы газ далее подается в печь 3, где нагревается до 850 °С и поступает в реактор синтеза 4. Конверсия природного газа осуществляется при температуре 850 °С и давлении 1,5–3,0 МПа. В качестве катализатора используются Ni, Fe и др. Реакционная смесь из реактора поступает в теплообменник 5 (или котел-утилизатор), в котором за счет отдачи тепла продуктами синтеза производится пар высоких параметров. Из теплообменника 5 реакционная смесь подается в скруббер 6, в котором путем орошения водой реакционные газы отмываются от сажи и СО2. Отмытый от сажи и СО2 синтез-газ поступает на мембранную секцию 7 для выделения избыточного водорода с помощью мембранной технологии (фирма «Mоnsanto»).
Источник статьи: http://chemanalytica.com/book/novyy_spravochnik_khimika_i_tekhnologa/06_syre_i_produkty_promyshlennosti_organicheskikh_i_neorganicheskikh_veshchestv_chast_II/5020
Синтез-газ
Определение
Понятие «синтез-газ» применяют к разным смесям монооксида углерода (СО) и водорода (Н2), которые используются для получения некоторых нефтехимических продуктов. Его в основном получают из природного газа (метана). Действительно, важнейшие вещества — аммиак, метанол и парафиновые углеводороды — получают именно из синтез-газа.
Получение
Существуют два основных метода получения синтез-газа – конверсия метана с водяным паром и парциальное (частичное) окисление. Оба метода довольно просты.
Конверсия метана с паром
Конверсия с паром состоит в пропускании метана или нафты и водяного пара над никелевым катализатором. Реакция протекает за счет разрушительной силы высоких температур и давлений, и ее следует проводить в реакторах, аналогичных печам крекинга. При этом происходят побочные процессы, при водящие к образованию СО2 и углерода. Углерод откладывается на катализаторе и дезактивирует его.
Парциальное окисление метана
Другой метод — это парциальное (частичное) окисление метана. Процесс проводят при высоких температурах без катализатора. Метод парциального окисления обычно используют для превращения более тяжелых видов сырья — от нафты до остаточного топлива — в тех случаях, когда в распоряжении нет природного газа и легких углеводородов (этана, пропана и бутана). В обоих процессах выход суммы СО и Н2 составляет 90 – 95%.
В качестве побочного продукта получают СО2, который можно удалить либо экстракцией растворителем, либо можно ввести в реакцию с водяным паром дополнительное количество метана, что даст СО и Н2. Эта реакция протекает при высоких температурах и давлениях и в присутствии никелевого катализатора.
Транспортировка
Обычно установка по производству синтез-газа бывает интегрирована в структуру завода, на котором он перерабатывается.
Единственным приемлемым способом транспортировки синтез-газа является его транспортировка по трубопроводам.
Применение
Получение аммиака
Наиболее важной областью применения синтез-газа является производство аммиака – NH3.
Смесь азота и водорода пропускают над железным катализатором (который содержит оксид алюминия в качестве промотора). Реакция проходит в очень жестких условиях — при температуре 420 С и давлении 280 атм.
Большая часть установок по производству аммиака снабжена оборудованием для отделения СО от сырья, так как СО может отравлять катализатор. Чаще всего с этой целью СО обрабатывают водяным паром для получения СО и Н2. Диоксид углерода удаляют экстракцией этаноламином, а Н2 направляют на рециркуляцию.
Получение метанола
Метанол часто называют древесным спиртом. Это связано с тем, что первым промышленным способом получения метанола была сухая перегонка свежеспиленной древесины лиственных деревьев. Помимо других соединений в летучей фракции присутствует метанол. Отсюда и произошло название «древесный спирт».
С 1923 г. метанол производится в промышленности из синтез-газа; в настоящее время большую часть метанола получают именно таким методом. По нескольким причинам эти установки обычно строят вблизи установок для производства аммиака или даже объединяют с ними.
Технология и оборудование аналогичны, и в производстве метанола можно использовать СО2, образующийся при синтезе аммиака. В этом случае СО2 вводят в реакцию с метаном и водяным паром над никелевым катализатором, приводящую к образованию дополнительного количества СО и Н2, которые затем взаимодействуют, давая метанол.
Процесс проводят при давлении 67 – 100 атм. И температуре 200 – 260оС на катализаторах на основе оксидов меди и цинка.
Синтез Фишера-Тропша
Каталитическое гидрирование оксида углерода (синтез Фишера-Тропша) для получения углеводородов, в частности парафинов, в основном нормального строения и олефинов, является гетерогенной реакцией. Проводится она преимущественно над кобальтовыми или над железными катализаторами с использованием возможно более чистых смесей оксида углерода и водорода. Оптимальные рабочие температуры синтеза различны для различных катализаторов.
Никелевые и кобальтовые катализаторы дают оптимальные результаты при 170-205, железные — при 200-325°С. Синтез на никелевых катализаторах ведется практически только при нормальном давлении, так как при повышенном давлении резко усиливается образование карбонилов.
На железном и кобальтовом катализаторах можно работать без образования карбонилов при давлениях до 20 атм.
Считается, что при синтезе по Фишеру-Тропшу на железных катализаторах оксид углерода гидрируется с образование метиленовой группа, которая затем полимеризуется. Оксид углерода конвертируется в углекислоту. При этом кислород оксида углерода связывается, образуя воду. Этим реакциям благоприятствуют более высокая температура синтеза на железных катализаторах и активность железа по отношению к реакции конверсии.
С технической точки зрения решающее значение при синтезе Фишера-Тропша имеют, во-первых, очень большая теплота реакции каталитического гидрирования оксида углерода и, во-вторых, необходимость очень точного соблюдения постоянной температуры синтеза. В противном случае значительно возрастает нежелательное образование метана. Кроме того, при высоких температурах наблюдается отложение углерода на катализаторе, приводящее к быстрой его дезактивации.
Источник статьи: http://pronpz.ru/neft/sintez-gaz.html
Синтез газ: способы получения, производство, состав и применение
История человечества знает довольно много примеров, когда в силу необходимости рождались кардинально новые подходы к решению существующих жизненно важных проблем. Например, в Германии в промежуток между первой и второй мировыми войнами, лишенной доступа к крупным нефтяным источникам, назревал серьезный дефицит топлива, которое было необходимо для функционирования гражданской и военной техники.
Располагая существенными запасами ископаемого угля, Германия начала искать пути его трансформации в жидкое топливо, пригодное для двигателей внутреннего сгорания. Эта проблему удалось решить благодаря усилиям превосходных химиков, из которых отдельного упоминания заслуживает Франц Фишер, директор Института кайзера Вильгельма по исследованию угля.
В 1926 году Ф. Фишер и Г. Тропш опубликовали работу «О прямом синтезе нефтяных углеводородов при нормальном давлении», где сообщалось, что при восстановлении монооксида углерода водородом при нормальном атмосферном давлении в присутствии катализаторов при температуре в 270 градусов по шкале Цельсия можно получить жидкие и твердые гомологи метана.
Так на свет появился знаменитый способ синтеза углеводородов из монооксида углерода, называемый с тех пор методом Фишера-Тропша. Благодаря данному методу смесь водорода и угарного газа в различных соотношениях может легко быть получена как из каменного угля, так и из любого другого сырья, содержащего углерод. Полученную в результате данного процесса смесь газов начали называть синтез-газом.
Состав синтез-газа
Как мы уже упомянули выше, в состав синтез-газа входят такие вещества как CO и H2. В зависимости от метода получения синтез-газа соотношение CO:Н2 в нем варьируется от 1:1 до 1:3. В прямой зависимости от применяемого сырья и метода его соотношение компонентов в синтез-газе изменяется в широких пределах. Как правило, процентное содержание веществ в сыром неочищенном синтез-газе следующее:
Стоит заметить, что данное соотношение является весьма приблизительным, поскольку повышением температуры в процессе синтеза можно увеличить количество СО, а увеличив давление можно повысить содержание Н2 и СН4.
Также, помимо данных веществ синтез-газ может содержать и другие вещества – инертные газы (N2) и серосодержащие соединения (H2S), если исходное сырье содержало серу. От не нужного присутствия в синтез-газе таких веществ как углекислый газ и сера избавляются путем очистки селективными растворителями.
Способы получения синтез-газа
Первым известным человечеству способом получения синтез-газа была газификация каменного угля. Данный способ был осуществлен в Англии еще в 30-е годы XIX века, и во многих странах мира до 50-х годов XX века. Впоследствии данная методика была вытеснена методами, основанными на использовании нефти и природного газа. Однако в связи с существенным сокращением мировых нефтяных ресурсов, значение процесса газификации каменного угля снова стало возрастать. К тому же, благодаря такому необходимому процессу как переработка ТБО, ученые научились добывать синтез-газ из новых, нетрадиционных источников.
Сегодня существуют три основных метода получения синтез-газа.
1. Газификация угля. Данный процесс основан на взаимодействии каменного угля с водяным паром и происходит по формуле:
Данная реакция является эндотермической, и равновесие при температуре 900-1000 по шкале Цельсия сдвигается вправо. Разработаны различные технологические процессы, использующие парокислородное дутье, благодаря которому наряду с упомянутой реакцией параллельно протекает экзотермическая реакция сгорания угля, которая обеспечивает необходимый тепловой баланс. Ее формула:
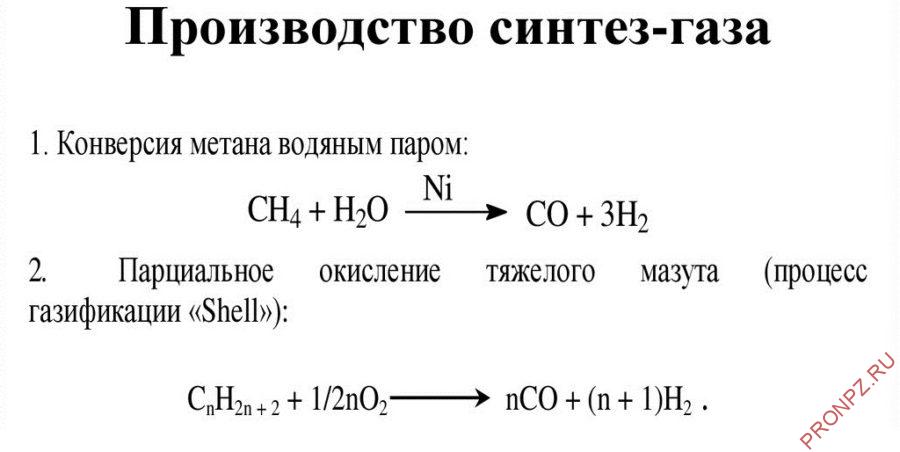
2. Конверсия метана. Данная реакция взаимодействия водяного пара и метана проводится при повышенной температуре (800-900 градусов) и давлении при присутствии никелевых катализаторов (Ni-Al2O3). Формула данного процесса:
CH4 + H2O → CO + 3H2 .
Также в качестве сырья в данном способе вместо метана можно использовать любое сырье, содержащее углеводород.
3. Парциальное окисление углеводородов. Данный процесс, происходящий при температурах выше 1300 градусов заключается в термическом окислении углеводородов. Формула данной реакции:
CnH2n + 2 + 1/2nO2 → nCO + (n + 1)H2 .
Данный способ применим к любому сырью, содержащему углеводороды но наиболее часто используется высококипящая фракция нефти — мазут.
Производство синтез-газа
Сегодня производство синтез-газа постоянно совершенствуется, поскольку востребованность данного сырья неизменно растет с каждым годом. В настоящее время учеными разрабатываются проекты подземной газификации угля, то есть планируется, что получение синтез-газа будет происходить непосредственно в пласте угля глубоко под землей. Интересен тот факт, что подобную идею уже высказывал известнейший русский ученый Д.И. Менделеев, причем более 150 лет назад.
Также благодаря современным разработкам сегодня синтез-газ научились получать газификацией не только угля и нефти, но и более нетрадиционных источников углерода, вплоть до бытовых и сельскохозяйственных отходов. Таким образом, сегодня мусороперерабатывающие заводы способны добывать такое ценное сырье как синтез газ в процессе утилизации отходов.
Применение синтез-газа
Сегодня синтез-газ используется в химической промышленности для получения различного сырья. Кроме этого, он также используется в качестве экологически чистого источника тепла и энергии. Сжигая синтез-газ можно получить достаточно большое количество тепла, которое можно использовать в самых различных целях.
Кроме этого, синтез газ используется в качестве исходного сырья для метилового спирта и синтетического жидкого топлива, которое по своим характеристикам ни в чем не уступает традиционному.
Источник статьи: http://ztbo.ru/o-tbo/stati/gaz/sintez-gaz-sposoby-polucheniya-proizvodstvo-sostav-i-primenenie