- Урок по теме «Сернистый газ. Сернистая кислота». 9-й класс
- Презентация к уроку
- Схема применения сернистого газа 9 класс
- а) сернистый газ
- Получение
- Свойства
- Применение
- б) оксид серы (VI)
- Получение
- Свойства
- Применение
- Схема применения сернистого газа 9 класс
- Оксид серы (IV) SO2, сернистый газ
- Химические свойства сернистого газа
- Получение и применение сернистого газа
- Урок в 9 классе по теме: «Сернистый газ. Сернистая кислота» методическая разработка по химии (9 класс) по теме
- Скачать:
- Предварительный просмотр:
Урок по теме «Сернистый газ. Сернистая кислота». 9-й класс
Класс: 9
Презентация к уроку
Создать условия для нравственного и эстетического воспитания учащихся к окружающей среде, умения работать в парах при самоанализе контрольных срезов, тестов.
развивать умение работать в атмосфере поиска, творчества, дать каждому учащемуся возможность достичь успеха; умение давать самооценку деятельности на уроке;
организовать деятельность учащихся на усвоение:
- знаний : химические свойства и способы получения сернистого газа и сернистой кислоты;
- умений: записывать уравнения химических реакций, характеризующих химические свойства сернистой кислоты и её солей в ионном и окислительно-восстановительном виде.
II. Изучение нового материала:
SO2 (сернистый газ, оксид серы (IV)), молекулярная формула

2. Физические свойства
1. В промышленности: обжиг сульфидов.
а) Составить электронный баланс (ОВР).
2. В лабораторных условиях: взаимодействие сульфитов с сильными кислотами:
3. При окислении металлов концентрированной серной кислотой:
б) Составить электронный баланс (ОВР).
4. Химические свойства SO2
1. Взаимодействие с водой
При растворении в воде образуется слабая и неустойчивая сернистая кислота H2SO3 (существует только в водном растворе).
2. Взаимодействие со щелочами:
3. Взаимодействие с основными оксидами (образуется соль):
4. Реакции окисления, SO2 – восстановитель:
в) Составить электронный баланс (ОВР)
г) Составить электронный баланс (ОВР)
д) Составить электронный баланс (ОВР)
5. Реакции восстановления, SO2 — окислитель
SO2 + С → S + СO2 (при нагревании)
е) Составить электронный баланс (ОВР)
ж) Составить электронный баланс (ОВР)
1. Сернистая кислота диссоциирует ступенчато:
H2SO3 ↔ H + + HSO3 — (первая ступень, образуется гидросульфит – анион)
HSO3 — ↔ H+ + SO3 2- (вторая ступень, образуется анион сульфит)
H2SO3 образует два ряда солей:
2. Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами:
з) Составить электронный баланс (ОВР)
Осуществите превращения по схеме:
Уравнения реакций ионного обмена напишите в полном и кратком ионном виде.
Ответы для самопроверки выводятся на экране.
Ответьте на вопросы в таблице “Вопросы к ученику” (Приложение 1).
V. Домашнее задание (дифференцированно)
Сделать задания выделенные красным шрифтом:
Уравнения а – е – “4”
Вопросы к ученику
Дата ___________________ Класс ______________________
Постарайся точно вспомнить то, что слышал на уроке и ответь на поставленные вопросы:
Источник статьи: http://urok.1sept.ru/articles/617352
Схема применения сернистого газа 9 класс
Охарактеризуйте: а) сернистый газ; б) оксид серы (VI) по плану: получение, свойства, применение. Напишите уравнения соответствующих реакций.
а) сернистый газ
Получение
В промышленности – сжигание серы или обжиг пирита:
S + O2 ⟶ SO2
2FeS2 + 5O2 ⟶ 2FeO + 4SO2
Свойства
Относится к кислотным оксидам.
Взаимодействует с водой с образованием сернистой кислоты:
H2O + SO2 ⟶ H2SO3
Взаимодействует с щелочами с образованием сульфитов:
2NaOH + SO2 ⟶ Na2SO3 + H2O
Проявляет как окислительные, так и восстановительные свойства, т. к. сера находится в промежуточной степени окисления +4.
| 2SO2 + 2NO ⟶ N2 + 2SO3 | ||
| 2N +2 + 4ē ⟶ N2 +6 | 1 | окислитель (восстановление) |
| S +4 — 2ē ⟶ S +6 | 2 | восстановитель (окисление) |
| SO2 + C t ⟶ S + CO2 | ||
| S +4 + 4ē ⟶ S 0 | 1 | окислитель (восстановление) |
| C 0 — 4ē ⟶ C +4 | 1 | восстановитель (окисление) |
Применение
Большая часть оксида серы (IV) используется для производства сернистой кислоты и оксида серы (VI). Также используется в качестве консерванта (пищевая добавка E220), и для отбеливания соломы, шёлка и шерсти.
б) оксид серы (VI)
Получение
В промышленности – окисление оксида серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5):
2SO2 + O2 t,V₂O₅ ⟶ 2SO3
Свойства
Относится к кислотным оксидам.
Взаимодействует с водой с образованием серной кислоты:
H2O + SO3 ⟶ H2SO4
Взаимодействует с основными оксидами с образованием сульфатов:
CaO + SO3 ⟶ CaSO4
Взаимодействует с щелочами с образованием сульфатов:
2NaOH + SO3 ⟶ Na2SO4 + H2O
Проявляет только окислительные свойства, т. к. сера находится в максимальной степени окисления +6.
| 2SO3 ⇄ 2SO2 + O2 | ||
| S +6 + 2ē ⟶ S +4 | 1 | окислитель (восстановление) |
| 2O -2 — 4ē ⟶ O2 0 | 1 | восстановитель (окисление) |
Применение
Оксид серы (IV) используют в основном для производства серной кислоты.
Источник статьи: http://gomolog.ru/reshebniki/9-klass/gabrielyan-2014/27/2.html
Схема применения сернистого газа 9 класс
SO 2 (сернистый ангидрид; сернистый газ)
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1 V H 2 O растворяется 40 V SO 2 при н.у.); более чем в два раза тяжелее воздуха, ядовит; t ° пл. = -75,5 ° C ; t ° кип. = -10 ° С.
Обесцвечивает многие красители, убивает микроорганизмы.
1) При сжигании серы в кислороде:
2) Окислением сульфидов:
3) Обработкой солей сернистой кислоты минеральными кислотами:
4) При окислении металлов концентрированной серной кислотой:
1) Сернистый ангидрид — кислотный оксид .
· взаимодействие с водой
При растворении в воде образуется слабая и неустойчивая сернистая кислота H 2 SO 3 (существует только в водном растворе)
H 2 SO 3 ↔ H + + HSO 3 — (первая ступень, образуется гидросульфит – анион)
HSO 3 — ↔ H + + SO 3 2- (вторая ступень, образуется анион сульфит)
H 2 SO 3 образует два ряда солей — средние (сульфиты) и кислые (гидросульфиты).
Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO 2 с резким запахом:
Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
· взаимодействие со щелочами
Ba ( OH )2 + SO 2 → BaSO 3 ↓ (сульфит бария) + H 2 O
Ba ( OH )2 + 2 SO 2 (избыток) → Ba ( HSO 3 )2 (гидросульфит бария)
· взаимодействие с основными оксидами
2) Реакции окисления, SO 2 — восстановитель ( S +4 – 2ē → S +6 )
2 SO 2 + O 2 → 2 SO 3 (катализатор – V 2 O 5 )
Водные растворы сульфитов щелочных металлов окисляются на воздухе:
3) Реакции восстановления, SO 2 — окислитель ( S +4 + 4ē → S 0 )
SO 2 + С → S + С O 2 (при нагревании)
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Закончите уравнения химических реакций, составьте электронный баланс, укажите процессы окисления и восстановления, окислитель и восстановитель:
Осуществите превращения по схемам:
Уравнения реакций ионного обмена напишите в полном и кратком ионном виде.
Источник статьи: http://www.sites.google.com/site/himulacom/zvonok-na-urok/9-klass—vtoroj-god-obucenia/urok-no19-sernistyj-gaz-sernistaa-kislota-i-eee-soli
Оксид серы (IV) SO2, сернистый газ
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) — сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) — серный ангидрид
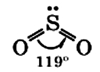
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
Физические свойства сернистого газа:
- бесцветный ядовитый газ с резким запахом;
- в 2 раза тяжелее воздуха;
- хорошо растворим в воде — при н.у. в 1 объеме воды растворяется 40 объемов SO2 (IV) с образованием сернистой кислоты.
Химические свойства сернистого газа
Сернистый газ является типичным кислотным оксидом.
- сернистый газ реагирует с основаниями с образованием гидросульфитов (кислые соли) и сульфитов (средние соли):
- реакции сернистого газа с основными оксидами:
- с водой образует сернистую кислоту, которая существует только в растворе и относится к двухосновным кислотам:
Ступенчатая диссоциация сернистой кислоты с образованием гидросульфит-иона на первой ступени диссоциации, и сульфит-иона — на второй:
- пример реакции сернистой кислоты в качестве восстановителя:
- пример реакции сернистой кислоты в качестве окислителя:
Сернистая кислота может образовывать средние соли (сульфиты) — Na2SO3, и кислые соли (гидросульфиты) — NaHSO3.
В окислительно-восстановительных реакциях сернистый газ может выступать, как в роли окислителя (восстанавливаясь в S и H2S), так и в роли восстановителя (окисляясь в H2SO4), т.к. сера в этом соединении занимает промежуточную степень окисления +4.
- в реакции с сероводородом сернистый газ является окислителем:
- в реакции с кислородом при нагревании сернистый газ является восстановителем:
Получение и применение сернистого газа
В промышленности сернистый газ получают или сжиганием серы, или как побочный продукт обжига сульфидных руд, например, железного колчедана.
В лабораторных условиях диоксид серы можно получить действием концентрированных кислот на соли сернистой кислоты (гидросульфиты и сульфиты), а также в процессе реакции серной кислоты с тяжелым металлом.
Сернистый газ используют для:
- получения оксида серы (VI);
- получения серной кислоты;
- получения сульфитов и гидросульфитов;
- отбеливания тканей в текстильной промышленности;
- уничтожения вредных микроорганизмов в качестве дезинфицирующего средства при консервировании продуктов питания.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Источник статьи: http://prosto-o-slognom.ru/chimia/503_oksid_sery_SO2.html
Урок в 9 классе по теме: «Сернистый газ. Сернистая кислота»
методическая разработка по химии (9 класс) по теме
На этом уроке рассматриваются химические свойства и способы получения сернистого газа и сернистой кислоты.
Отрабатываются умения записывать уравнения химических реакций, характеризующих химические свойства сернистой кислоты и её солей в ионном и окислительно-восстановительном виде.
Скачать:
| Вложение | Размер |
|---|---|
| urok_sernistyy_gaz._sernistaya_kislota.doc | 52.5 КБ |
Предварительный просмотр:
Урок в 9 классе по теме: « Сернистый газ.
Сернистая кислота и её соли».
Создать условия для нравственного и эстетического воспитания учащихся к окружающей среде, умения работать в парах при самоанализе контрольных срезов, тестов.
развивать умение работать в атмосфере поиска, творчества, дать каждому учащемуся возможность достичь успеха; умение давать самооценку деятельности на уроке;
организовать деятельность учащихся на усвоение:
- знаний: химические свойства и способы получения сернистого газа и сернистой кислоты;
- умений: записывать уравнения химических реакций, характеризующих химические свойства сернистой кислоты и её солей в ионном и окислительно-восстановительном виде.
- Оргмомент.
- Изучение нового материала:
SO 2 (сернистый газ, оксид серы (IV)), молекулярная формула
- Физические свойства
- Бесцветный газ с резким запахом, ядовит.
- Хорошо растворим в воде (в 1V H 2 O растворяется 40V SO 2 при н.у.)
- Тяжелее воздуха, ядовит.
- Получение
- В промышленности: обжиг сульфидов.
FeS 2 + O 2 → Fe 2 O 3 + SO 2 ↑
а) Составить электронный баланс (ОВР)
- В лабораторных условиях: взаимодействие сульфитов с сильными кислотами:
Na 2 SO 3 + 2HCl → 2NaCl + SO 2 ↑ + H 2 O
- При окислении металлов концентрированной серной кислотой:
Cu + H 2 SO 4(конц) → CuSO 4 + SO 2 ↑ + H 2 O
б) Составить электронный баланс (ОВР)
- Химические свойства SO 2
- Взаимодействие с водой
При растворении в воде образуется слабая и неустойчивая сернистая кислота H 2 SO 3 (существует только в водном растворе)
SO 2 + H 2 O ↔ H 2 SO 3
- Взаимодействие со щелочами:
Ba(OH) 2 + SO 2 → BaSO 3 ↓(сульфит бария) + H 2 O
Ba(OH) 2 + 2SO 2 (избыток) → Ba(HSO 3 ) 2 (гидросульфит бария)
- Взаимодействие с основными оксидами (образуется соль):
SO 2 + CaO = CaSO 3
- Реакции окисления, SO 2 – восстановитель:
SO 2 + O 2 → SO 3 (катализатор – V 2 O 5 )
в) Составить электронный баланс (ОВР)
SO 2 + Br 2 + H 2 O → H 2 SO 4 + HBr
г) Составить электронный баланс (ОВР)
SO 2 + KMnO 4 + H 2 O → K 2 SO 4 + MnSO 4 + H 2 SO 4
д) Составить электронный баланс (ОВР)
- Реакции восстановления, SO 2 — окислитель
SO 2 + С → S + СO 2 (при нагревании)
е) Составить электронный баланс (ОВР)
SO 2 + H 2 S → S + H 2 O
ж) Составить электронный баланс (ОВР)
- Химические свойства H 2 SO 3
- Сернистая кислота диссоциирует ступенчато:
H 2 SO 3 ↔ H + + HSO 3 — (первая ступень, образуется гидросульфит – анион)
HSO 3 — ↔ H+ + SO 3 2- (вторая ступень, образуется анион сульфит)
H 2 SO 3 образует два ряда солей:
- Раствор сернистой кислоты H 2 SO 3 обладает восстановительными свойствами:
H 2 SO 3 + I 2 + H 2 O = H 2 SO 4 + НI
з) Составить электронный баланс (ОВР)
Осуществите превращения по схеме:
S → H 2 S → SO 2 → Na 2 SO 3 → BaSO 3 → SO 2
Уравнения реакций ионного обмена напишите в полном и кратком ионном виде.
Ответы для самопроверки выводятся на экране.
Ответьте на вопросы в таблице «Вопросы к ученику» (Приложение 1).
- Домашнее задание (дифференцированно)
Сделать задания выделенные красным шрифтом:
Источник статьи: http://nsportal.ru/shkola/khimiya/library/2013/03/17/urok-v-9-klasse-po-teme-sernistyy-gaz-sernistaya-kislota